Valenzschalen-Elektronenpaar-Abstoßung (VSEPR)
Die Valenzschalen-Elektronenpaar-Abstoßung, auch VSEPR-Modell genannt, beschreibt die Geometrie, die Moleküle oder kovalente Gitter bildet.
Der Chemiephysiker Gilbert Newton Lewis schlug 1916 die kovalente Bindung zwischen Atomen vor. Diese Bindung wird durch die gemeinsame Nutzung von Elektronenpaaren hergestellt. Demnach erhält jedes Atom 8 Elektronen in der Valenzschale.
Ein anschauliches Beispiel ist das Fluoratom, das 7 Elektronen in der elektronischen Valenzschale hat.
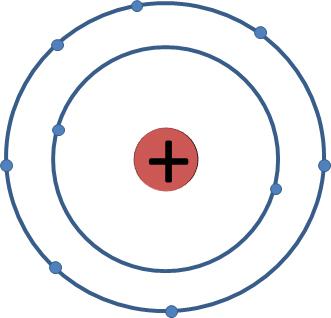
In einer Struktur ist es sehr schwierig, die Geometrie zu unterscheiden, sowohl die molekulare Geometrie als auch den Grad, in dem sich die Bindungen untereinander bilden. Aus diesem Grund wird die Theorie der Abstoßung der Elektronenpaare in der Valenzschale zur Bestimmung der Molekülgeometrie verwendet. Sie stammt aus dem Jahr 1970 von Gillespie, diese Theorie soll die Unterscheidung von Geometrie und Winkeln erleichtern.
Das Valenzschalen-Elektronenpaar-Abstoßungsmodell
Das VSEPR-Modell erklärt, dass die Geometrie die Abstoßung zwischen den verschiedenen Elektronenpaaren um das Zentralatom verringern kann, da sich die Elektronen gegenseitig abstoßen, weil sie negativ geladen sind.
Die Theorie der Valenzschalen-Elektronenpaar-Abstoßung ist das Vorbild in der Chemie für die Form von Molekülen, die auf dem Grad der elektrostatischen Abstoßung der Elektronenpaare beruht.
Wie wir unten sehen können, gibt es verschiedene Arten von Molekülgeometrien:
Trigonale Bipyramide
Wippe
T
Linear
| Molekulare Geometrie | Hybridisierung des Atoms A | Winkel -A- |
| Trigonale Bipyramide | Sp3d | 90/120 |
| Wippe | Sp3d | 90/120 |
| T | Sp3d | 90/120 |
| Linear | Sp3d | 90/120 |
Arten der Abstoßung
Es gibt drei Arten der Abstoßung zwischen den Elektronen in einem Molekül:
- Die Abstoßung nichtbindendes Paar – nichtbindendes Paar
- Die Abstoßung nichtbindendes Paar – gebundenes Paar
- Die Abstoßung gebundenes Paar – gebundenes Paar
Die Abstoßung des nicht bindenden Paares wird als frei betrachtet, während die Abstoßung des bindenden Paares eine chemische Bindung voraussetzt.
Je nach Anzahl der Elektronen in der Valenzschale können wir die eine oder andere Anordnung der Elektronen sehen.
| ANZAHL DER VALENZELEKTRONENPAARE | ANORDNUNG DER ELEKTRONENPAARE |
| 2 | Linear |
| 3 | Planar trigonal |
| 4 | Tetraedrisch |
| 5 | Trigonale Bipyramide |
| 6 | Oktaeder |
Ein anschauliches Beispiel für die Theorie der Abstoßung von Elektronenpaaren in der Valenzschale ist Ammoniak (NH3). Ammoniak hat drei gebundene Elektronen und ein einsames Elektronenpaar. Die einsamen Elektronen beeinflussen die Geometrie durch Abstoßung. Das NH3-Molekül gehört zur Gruppe AB3E und hat aufgrund des ungepaarten Elektronenpaars ein E.